取质量为4.6g的纯净的金属钠平均分成两等份,做如下实验:
(1)第一块直接投入适量的水中,充分反应后得到了气体A和200mL溶液(甲);
(2)另一块在干燥氧气中受热后转化成3.5g固体(经检验固体中不含金属钠的单质),再将所得固体全部投入适量的水中,充分反应后得到气体B和200mL溶液(乙)。求:
①同温同压下,气体A和气体B的密度之比为 ;
②溶液甲的物质的量浓度= ;
③溶液的物质的量浓度:甲 乙(填 “>”、“=”、“<”、“无法确定”);
④3.5g固体所含成分是 。
| A.只含Na2O | B.只含Na2O2 |
| C.既含Na2O又含Na2O2 | D.无法确定 |
有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置。
⑵元素A的非金属(填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子(填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式。
⑸氧化铜与D的单质在高温下发生化学反应的方程式
,若得到1mol氧化产物,则该反应转移电子mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因。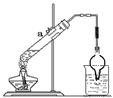
选择下列物质分离和检验方法,将其序号填在横线上。
| A.萃取 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体。
0.5mol H2SO4的质量是g,含个氧原子,能和molNaOH完全反应,该硫酸所含氢元素的质量与mol H3PO4或标准状况下L HCl中所含氢元素的质量相同。
成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入 ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有
(写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做 。
②写出化合物A与CH3COOH反应的化学方程式为 ,该反应的类型为 。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g和 3.52g。则分子中C、H原子的个数比 。苹果酸的分子式是 。
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______________________。
(2)若将1中的反应设计成原电池,请画出原电池的装置图__________________(标出正、负极材料及电解质溶液),并写出电极反应式。
正极反应________________,负极反应__________________。
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显。请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种水可任选,设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式①_____________________________
②_____________________________。
劣质不锈钢腐蚀的实验现象_____________________________。
(4)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=== 4LiCl+S+SO2。该电池正极发生的电极反应为____________________________。