在一个固定体积的密闭容器中,2molA和1molB发生反应2A(g)+ B(g) 3C(g)+D(g),达到平衡时,C的浓度为W mol/L。维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L。维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是
| A.3molC+1molB | B.1molA+0.5molB+1.5molC+0.5molD |
| C.4molA+2molB | D.3molC+1molD+2molA+1molB |
根据中学所学相关知识,下列推断正确的一项是
| A.ⅣA族元素形成的氢化物的沸点从上到下依次递增,则VA族元素所形成的氢化物的沸点从上到下也是依次递增 |
| B.氯气可置换出KBr溶液中的溴,则氟气也可置换出KBr溶液中的溴 |
| C.某浓度的NaClO溶液的pH=d则其中由水电离出的c(H-)=10-14+dmol.L-l |
| D.某温度下,MgCO3的KSP=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.8×10-6 |
溶液中,有关物质的量浓度关系正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3—)
B.1.0 mol.L-1·Na2C2O4溶液:c(OH-)=c(HC2O4—)十c(H+)+ c(H2C2O4)
C.pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
D.将0.2 mol.L-1的某一元酸HA溶液和0.1 mol.L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A一)=c(H+)+c(HA)
已知NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0. 020 mol/L的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图;据图分析,下列判断不正确的是
| A.40℃之前,溶液变蓝的时间随温度的升高而缩短 |
| B.图中a点对应的NaHSO3反应速率为5.0×l0-5mol/(L·s) |
| C.图中b、c两点对应的NaHSO3反应速率相等 |
| D.40℃之后,淀粉不宜用作该实验的指示剂 |
电解Na2SO4溶液生Na2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)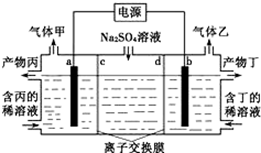
| A.a极反应式为:2H++2e一=H2↑ |
| B.产物丁为NaOH |
| C.c为阳离子交换膜 |
| D.每转移0. 2mol电子,产生l 12L气体甲 |
关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是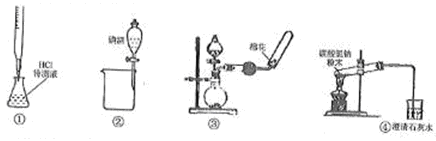
| A.利用装置①进行盐酸待测液浓度的测定 |
| B.利用装置②分离碘酒中碘和酒精 |
| C.利用装置③制备收集干燥氨气 |
| D.利用装置④加热分解碳酸氢钠 |