氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是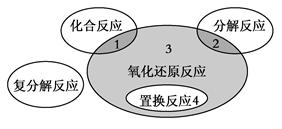
| A.4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
B.2NaHCO3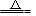 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.4NH3+5O2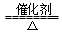 4NO+6H2O 4NO+6H2O |
| D.Zn+H2SO4===ZnSO4+H2↑ |
设NA为阿伏加德罗常数的值,下列叙述正确的是()
| A.标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA |
| B.pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA |
| C.在1L 0.1 mol·L-1 CuSO4溶液中,阴离子总数大于0.1 NA |
| D.某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
下列与平衡移动无关的是()
| A.向0.1 mol/L的CH3COOH中加水稀释,溶液pH增大 |
| B.向氯水中投入AgNO3,最终溶液酸性增强 |
| C.夏天,打开冰镇啤酒的盖子后,有大量的气泡冒出 |
| D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是( )
| A.(NH4)2SO3 | B.KMnO4 |
| C.AlCl3 | D.Na2CO3 |
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
| A.Ba(OH)2、Na2SO3、FeCl3、KCl |
| B.Na2SiO3、Na2CO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 |
| D.NaHCO3、CH3COOH、C2H5OH、HCl |
下列各组离子能大量共存,且溶液为无色透明的是()
| A.Al3+、AlO2-、NO3-、Cl- |
| B.CrO42-、H+、K+、NO3- |
| C.Ba2+、Na+、HCO3-、OH- |
| D.K+、SO42-、S2-、Na+ |