锌与很稀的硝酸反应4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
| A.2.5 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
下列叙述中正确的是
| A.在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热 |
| B.热化学方程式中,各物质前的化学计量数不表示分子个数 |
| C.在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
| D.如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热 |
已知某可逆反应mA(g)+nB(g) xC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强p与C在混合气体中的百分含量(C%)的关系曲线,则正确的是
xC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强p与C在混合气体中的百分含量(C%)的关系曲线,则正确的是
| A.T1>T2,p1>p2,m+n>x,正反应放热 |
| B.T1<T2,p1<p2,m+n<x,正反应吸热 |
| C.T1>T2,p1<p2,m+n<x,正反应放热 |
| D.T1<T2,p1>p2,m+n>x,正反应吸热 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 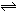 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
| A.若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B.若T2>T1,则正反应一定是放热反应 |
| C.达到平衡时A2的转化率大小为b>a>c |
| D.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,单位为mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如下表所示。下列关于该反应的反应速率的判断,正确的是
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,单位为mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如下表所示。下列关于该反应的反应速率的判断,正确的是
| c(X) |
c(Y) |
所需时间 |
| 0.10 |
0.10 |
0.60s |
| 0.20 |
0.10 |
0.15s |
| 0.20 |
0.05 |
0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的物质的量比容器Ⅱ中的少 |