已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
下列说法中错误的是
| A.a点表示的溶液中[CH3COO-]略小于10-3 mol·L-1 |
| B.b点表示的溶液中[CH3COO-]>[Na+] |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
在前人科学研究的基础上,归纳总结出元素周期律的科学家是
| A.居里夫人 | B.罗蒙诺索夫 | C.道尔顿 | D.门捷列夫 |
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)()
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)()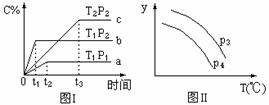
A.P3<P4y轴表示A的转化率
B. P3>P4y轴表示B的百分含量
C.P3>P4y轴表示混合气体的密度
D,P3>P4y轴表示混合气体的平均相对分子质量
下列说法正确的是()
A.若HA、HB均为弱酸,酸性HA>HB,则相同条件下,溶液的PH大小为NaA>NaB
B.相同条件下,将PH=11的NaOH溶液和氨水分别稀释为PH=9的溶液,则加水的体积前者大
C. PH=3的醋酸与PH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
D. 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA—)+c(A2—)+c(H2A)]
在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完 全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
| A.0.0020 | B.0.011 | C.0.11 | D.0.22 |
室温时,PH=10的氨水和碳酸钠溶液中,水电离产生的C( H+)前者与后者之比
| A.1:1 | B.10-10:10-4 | C.10-4: 10-10 | D.10-10:10-7 |