某实验小组对一含有Al3+的未知溶液进行分析,经定量分析后,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图: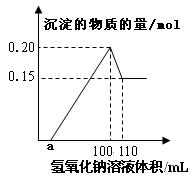
则下列说法中错误的是
| A.该未知溶液中至少含有3种阳离子 |
| B.滴加的NaOH溶液的物质的量浓度为5mol/L |
| C.若另一种离子为二价阳离子,则a="10" |
| D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g |
11)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是( )
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,W的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
下列排序正确的是( )
| A.酸性:H2CO3<C6H5OH<CH3COOH | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<BN | D.沸点:PH3<NH3<H2O |
X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )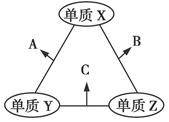
| A.X元素位于第ⅥA族 | B.A不能溶解于B中 |
| C.A和C不可能发生氧化还原反应 | D.B的沸点高于C的沸点 |
X、Y、Z、W是短周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序为X<Y<Z<W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.X、Z、W最高价氧化物对应水化物酸性的强弱顺序为Z<X<W |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
四种短周期元素W、X、Y、Z的原子序数依次递增,X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的混合溶液时,在阳极Y离子先失去电子。W和Z同主族。对于这四种元素下列判断正确的是( )
| A.气态氢化物的稳定性:W>X>Y>Z |
| B.单质的氧化性:W>Z>Y>X |
| C.四种元素原子半径大小:W<Y<Z<X |
| D.W单质可以将Z从其盐溶液中置换出来 |