一定条件下,容积为2 L的恒容密闭容器中,通入2 mol N2、3 mol H2进行反应
N2(g)+3H2(g)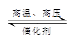 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是
| A.当容器内压强不改变时,说明反应已达到平衡状态 |
| B.增加H2的浓度或降低温度,平衡将向正反应方向移动,且反应速率均加快 |
| C.前20 min用NH3表示的反应速率为0.01 mol·L-1·min-1 |
| D.1 h后反应进行完全,容器中的N2浓度为0.55 mol·L-1 |
下图为氢氧燃料电池原理示意图,按此图的提示,下列叙述不正确的是 ( )。
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-="=" 2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
在下图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是()。
| A.碳棒上有气体放出 | B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极流到b极 | D.a极上发生了氧化反应 |
下列说法中正确的是()。
| A.原电池中的电极一定要由两种不同的金属组成 |
| B.原电池中电子流出的一极是正极,发生氧化反应 |
| C.原电池两极均发生氧化还原反应 |
| D.原电池中阳离子向正极移动 |
已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是()。
| A.金刚石比石墨稳定 | B.石墨转化为金刚石是物理变化 |
| C.石墨的能量比金刚石的能量高 | D.由石墨制备金刚石一定是吸热反应 |
下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A.铝片与稀盐酸的反应 | B.Ba(OH)2·8H2O和NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在氧气中的燃烧反应 |