(共15分)甲醇合成反应及其能量变化如图所示: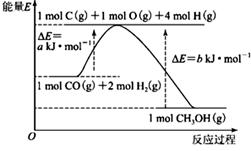
(1)写出合成甲醇的热化学方程式 。
(2)实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
| 300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2) 。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。使用铜基催化剂后,该反应中a的大小变化对反应热ΔH有无影响?(填有或无)_____________。
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图所示。
请写出从C口通入O2发生的电极反应式 。
(7)用上述电池做电源,用下图装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程 。
②电解开始后在电极___________的周围(填“C1”或“C2”)先出现红色。
(一)化学与生活
(1)良好的生态环境可以提升生活质量。
①空气污染指数API表明了空气的质量。空气污染指数主要是根据空气中、NO2和可吸入颗粒物等污染物的浓度计算出来的数值。
②下列物质可用作混凝剂是(填字母)。
a.ClO2b.FeCl3c.Ca(ClO)2
③已知,汽车尾气中的一氧化碳与一氧化氮在一定条件下反应可生成对空气无污染的物质,则该反应的化学方程式为。
(2)均衡的膳食结构可以保障身体健康。
①下列维生素中,能防治夜盲症的是,能预防佝偻病的是,能防治坏血病的是。(填字母)
a.维生素Ab.维生素Cc.维生素D
②葡萄糖在人体内被氧化,最终生成和,同时释放出能量。
(3)材料的不断发展可以促进社会进步。
①下列属于复合材料的是(填字母)。
a.石灰石b.普通玻璃c.钢筋混凝土
②ABS塑料可用于制造电视机、洗衣机的外壳,ABS塑料属于(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
③制造下列物质时,不需要石灰石的是(填字母)。
a.生石灰b.水泥c.光导纤维
④黄铜的主要组成元素是铜和(填元素名称)。铁器件在潮湿的空气中会发生腐蚀(填“化学”或“电化学”),为防止铁质地下管道的腐蚀可在其表面附着(填“锌块”或“石墨”)。
(I)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末.常用作颜料。已知氧化亚铜溶于稀硫酸生成Cu和CuSO4。某校化学实验小组为了探究由Fe2O3和Cu2O组成的混合物中两者物质的量相对大小,某同学认为只要取少量粉末放入足量稀硫酸中,通过观察现象即可。
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+= 2Fe3++3H2O
②③
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O)n(Fe2O3)。(填“>”、“<”或“=”)。
(II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g)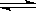 2C(g)
2C(g)
右反应室:2Z(g)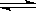 X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示: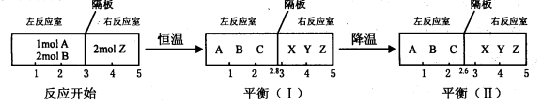
(1)A(g)+2B(g)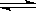 2C(g)的△H 0(填“>”、“<”或“=”)。
2C(g)的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数(填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为。
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。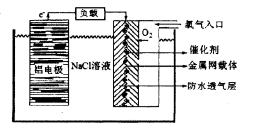
①该电池的总反应化学方程式为____;
②电池中NaCI的作用是。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式。
活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程: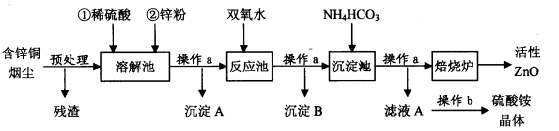
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____,在实验室中,该过程用到的主要玻璃仪器有。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;②:③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式:。
| 开始沉淀的pH |
沉淀完全的pH |
|
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| 2n2+ |
5.9 |
8.9 |
(5)操作b的名称是________;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为。
水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式:;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。