下列说法中正确的是
| A.在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B.相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C.100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D.14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
决定原子种类的因素是
| A.电子数 | B.质子数 | C.质子数和中子数 | D.质子数和电子数 |
体积相同、C(H+)相同的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是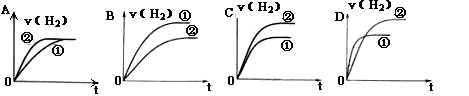
A. B. C. D.
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过O.2mol e-,锌的质量理论上减小6.5g |