(12分)中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(可能用到的相对原子质量:H—1 O—16 S—32) (1)仪器B的名称是 ,水通入A的进口为 。
(1)仪器B的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,写出该反应的离子方程式: 。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若滴定的实验操作如下:
①检查滴定管是否漏水
②用标准液润洗盛标准液的滴定管
③装标准溶液并调整液面(记录初读数)
④用蒸馏水洗涤玻璃仪器
⑤把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇至滴定终点,记下滴定管液面刻度。
则滴定操作的正确顺序是(用序号填写)____________________________;
(4)用标准NaOH溶液滴定时,以下操作引起误差偏大的是 。
| A.滴定前仰视,滴定后俯视 |
| B.盛标准液的滴定管用蒸馏水洗后未用标准液润洗 |
| C.颜色改变立即读数 |
| D.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡 |
(5)滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为 g·L-1
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分: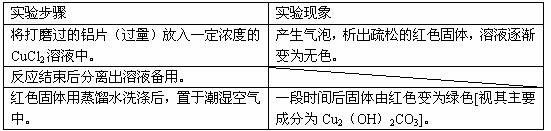
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________________________________;
化合反应____________________________________________________________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+。该反应的离子方程式是。
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于上(用以下所给仪器的编号填入,下同),取用坩埚应使用,灼烧后的坩埚应放在上,不能直接放在桌面上。
实验所用仪器:
a蒸发皿
b石棉网
c泥三角
d表面皿
e坩埚钳
f试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:、。
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。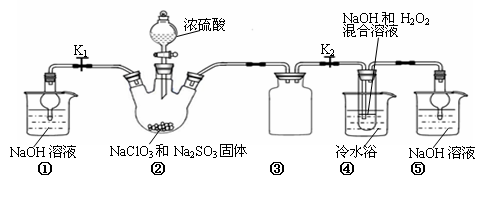
(1)装置①的作用是装置③的作用是。
(2)装置②中产生ClO2的化学方程式为。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是,达到滴定终点时的现象为。
(6)样品中NaClO2的质量分数为(用含m、c、V的代数式表示,式量:NaClO2 90.5)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为。
(2)发生器中鼓入空气的作用可能是(选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为。
吸收塔的温度不能超过20℃,其目的是。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是(选填序号)。
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是(填操作名称)
某兴趣小组设计如图装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。
(1)仪器G的名称是_________________。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则C中反应的离子方程式为_____________,证明SO2有氧化性的实验现象是___________________.
(3)为了实现绿色环保的目标,某同学设计装置F来代替装置A。与装置A相比,装置F的优点是____________________________(写出2点)。
(4)若选用装置F制取O2,可选用试剂_______________。
(5)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
已知:SO3遇水剧烈反应,放出大量热。产生酸雾;98.3%的H2SO4可以吸收SO3和酸雾。
供选试剂:蒸馏水、0.5 mol·L-1BaCl2溶液、98.3%的H2SO4、2.0 mol·L-1 NaOH溶液、KMnO4溶液。
①c中应选用的试剂是_________,e中试剂的作用是__________,f中收集的气体是____________。
②某同学提出用饱和NaHSO3溶液代替98.3%的H2SO4,请你评价该方案是否可行,若可以不必说明理由:若不可行。简述其理由__________。
(15分)某化学课外活动小组通过实验研究NO2的性质:(已知:2NO2+2NaOH = NaNO3+NaNO2+H2O)
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。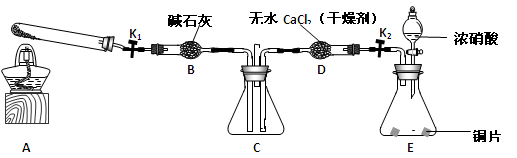
(1)E装置中制取NO2反应的离子方程式是。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③。
(4)此实验装置存在一个明显的缺陷是。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。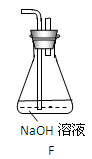
①装置的合理连接顺序是(某些装置可以重复使用)。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为。