由钠和氧组成的某种离子晶体中阴离子只有O2-和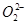 (过氧离子)。在此晶体中,氧元素和钠元素质量之比是48∶92,则其中O2-和
(过氧离子)。在此晶体中,氧元素和钠元素质量之比是48∶92,则其中O2-和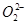 的物质的量之比为
的物质的量之比为
| A.2∶1 | B.1∶1 | C.1∶2 | D.1∶3 |
将铝粉和四氧化三铁粉末配成的铝热剂分成两等份:一份在高温下恰好反应,再与足量稀硫酸反应,生成氢气a L;另一份直接放入足量的氢氧化钠溶液中充分反应,在相同条件下生成氢气b L,则a︰b为
| A.1:1 | B.4:3 | C.3:4 | D.8:9 |
向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件, 一定减小的是
一定减小的是
①NaOH固体②NaHSO4固体③氯化钠水溶液
④CH3COONa固体⑤冰醋酸⑥降低温度
| A.①③④ | B.②③⑤ | C.②⑤⑥ | D.①④⑥ |
银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:
Ag2O2+2Zn+4KOH+2H2O=2K2Zn( OH )4+2Ag下列有关该电池的说法不正确的是
| A.电池放电时,正极附近溶液的碱性增强 |
B.电池放电时,负极反应为 |
C.电池充电时,阳极反应为 |
| D.充电时锌极与外电源正极相连 |
下述实验操作与预期实验目的或所得实验结论不一致的是
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.—定温度下,pH=6的纯水中含有OH-的数目为10-6 NA |
| B.120 g NaHSO4固体中含有的离子总数为2NA |
| C.标准状况下,22.4 L己烷中所含分子的数目为NA |
| D.100 mL 0.5 mol.L-1的(NH4)2SO4溶液中,NH4+的数目为 0.1 NA |