下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是
A.Cu、Ag、AgNO3溶液 B.Zn、Cu、稀H2SO4
C.Fe、Zn、ZnSO4溶液 D.Fe、C、Fe2(SO4)3溶液
可逆反应
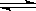
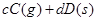
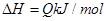 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )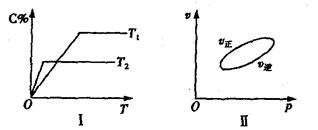
| A.T1<T2,Q>0 | B.增大压强,物质B的转化率增大 |
| C.反应达平衡后,增加少量的D,平衡逆向移动 | D.a+b>c+d |
实验室用标准盐酸测定未知浓度NaOH溶液,用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
| A.酸式滴定管在装酸液前未用标准酸液润洗 |
| B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失 |
| C.锥形瓶内溶液颜色由黄变橙时立即停止滴定 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:

 ,下列说法正确的是( )
,下列说法正确的是( )
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
下述实验不能达到预期实验目的的是( )
| 序号 |
实验内容 |
实验目的 |
| A |
将2.5gCuSO4·5H2O溶解在97.5g水中 |
配制质量分数为1.6%的CuSO4溶液 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
下列液体均处于25℃,下列有关叙述正确的是( )
| A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同 |
| B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13 |
| C.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
| D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1 |