25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
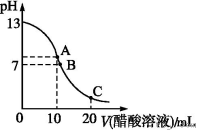
| A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-)) |
| C.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+) |
A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B
C.B>A>C D.B>C>A
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 |
| B.催化剂 |
| C.温度、压强以及反应物的接触面 |
| D.反应物的浓度 |
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是
| A.a中铁钉附近呈现红色 | B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 | D.b中铝条附近有气泡产生 |
下列反应属于吸热反应的是
| A.稀硫酸与氢氧化钾溶液反应 |
| B.氢气还原氧化铜的反应 |
| C.锌与稀硫酸的反应 |
| D.生石灰变成熟石灰的反应 |
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
| A.0.1 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.2 mol·L-1·min-1 | D.0.6 mol·L-1·min-1 |