发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1)氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g) ΔH =" +23.4" kJ·mol-1
NH3(g) ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3)研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。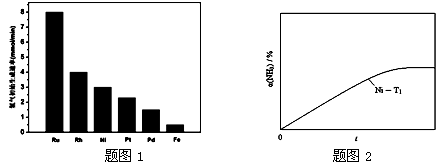
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g)  H2 (g)+I2 (g)
H2 (g)+I2 (g) 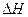 =" +A" kJ·mol
=" +A" kJ·mol K=4.0)
K=4.0)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol HI |
1 mol H2 + 1 1mol I2 |
2 mol HI + 1 mol H2+ 1 mol I2 |
HI的浓度(mol·L ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
 |
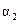 |
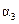 |
(1)根据上表回答问题
①c1、c3的关系式为
②a、b的关系式为
③p2、p3的关系式为
④ 与
与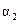 的关系式为
的关系式为
(2)甲容器中:该反应的 平衡常数表达式为。
平衡常数表达式为。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟的平均反应速率为mol·L ·min
·min (用含有c2的代数式表示)
(用含有c2的代数式表示)
(4)丙容器中:反应开始时进行的方向是(填“向 左”、“向右”或“不动”)
左”、“向右”或“不动”)
(5)乙容器中:当反应达到平衡状态后,向容器中再充入1 mol H2,则1分钟后,正反应速率与原平衡时相比(填“增大”、“不变”或“减小”)
(8分)
(1)表示含有20个中子的氯原子的符号为
(2)写出4核10电子分子的电子式
(3)已知一氧化碳的燃烧热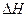 为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
(4)CH3OH与 O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是。
O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是。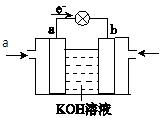
淡黄色固体X和气体A存在如下转化关系:
请回答下列问题:
(1)固体X的名称A的化学式。
(2)写出反应①的化学方程式,并指出氧化剂。
,。
(3)写出②④反 应的离子方程式:
应的离子方程式:
反应②。
反应④。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:;若反应过程中有2 mol电子发生转移,会有g Cu溶解。
(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤: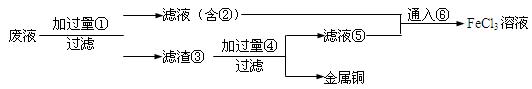 请写出上述试验过程中②⑤的化学式:
请写出上述试验过程中②⑤的化学式:
②,⑤。
请写出①⑥两步反应的离子方程式:;
。
已知: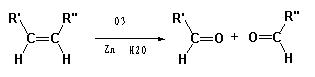
某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化: 结构分析表明F分子中含有两个甲基。请回答下列问题:
结构分析表明F分子中含有两个甲基。请回答下列问题:
(1)G的分子式为_____________。
(2)写结构简式:A________________________,E_____________________。
(3)A→B的反应方程式是____________________________________________。
D→F的反应方程式是____________________________________________。
(4)F 和 G____________(是或否)互称为同分异构体。