为了减少酸雨的产生,可采取的措施是
| A.工厂烟囱造高一些 | B.在酸化的土壤中加石灰 |
| C.将矿石燃料进行脱硫处理 | D.立即全面禁止使用化石燃料 |
某新型电池,以NaBH4(B的化合价为+3)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是 ( )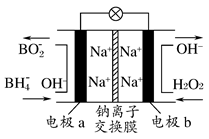
| A.电池工作时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移3 mol e- |
| C.b极上的电极反应式为:H2O2+2e-+2H+=2H2O |
| D.a极上的电极反应式为:BH4—+8OH--8e-=BO2—+6H2O |
用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是 ( )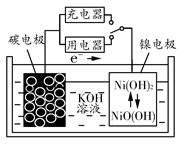
| A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O |
| B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C.放电时,OH-移向镍电极 |
| D.充电时,将电池的碳电极与外电源的正极相连 |
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
已知某反应A(g)+B(g) C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。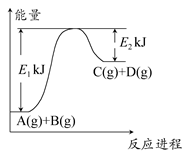
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是 ( )
A.N2(g)+3H2(g) 2NH3(g) ΔH=-93 kJ·mol-1 2NH3(g) ΔH=-93 kJ·mol-1 |
B.N2(g)+3H2(g)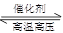 2NH3(g) ΔH=+1471 kJ·mol-1 2NH3(g) ΔH=+1471 kJ·mol-1 |
C.N2(g)+3H2(g)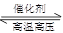 2NH3(g) ΔH=+93 kJ·mol-1 2NH3(g) ΔH=+93 kJ·mol-1 |
D.N2(g)+3H2(g)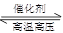 2NH3(g) ΔH=-1471 kJ·mol-1 2NH3(g) ΔH=-1471 kJ·mol-1 |