下列离子方程式书写正确的是
| A.Cl2与H2O反应:Cl2+H2O = 2H++Cl-+ClO- |
| B.碳酸氢钠溶液与稀硫酸反应:CO32-+2H+ = CO2↑+H2O |
| C.Fe2(SO4)3溶液与氨水反应:Fe3+ +3OH- = Fe(OH)3↓ |
| D.Na与H2O反应:2Na + 2H2O = 2Na+ + 2OH—+H2↑ |
NaClO2可用作造纸的漂白剂,它由:H2O2+2ClO2+2NaOH=2NaClO2+2H2O + O2制得,下列说法正确的是
| A.H2O2是氧化剂,H2O2中的氧元素被还原 |
| B.每生成1 mol O2转移的电子的物质的量为4 mol |
| C.ClO2中的氯元素被氧化 |
| D.ClO2是氧化剂,H2O2是还原剂 |
下列解释事实的化学方程式或离子方程式,不正确的是
| A.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ ="=" 2Cr3+ + Fe3+ + 7H2O |
| B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓ |
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) CaCO3(s) + Na2SO4(aq) CaCO3(s) + Na2SO4(aq) |
D.工业上可用电解法制备Mg:MgCl2(熔融) Mg + Cl2↑ Mg + Cl2↑ |
下列解释事实的离子方程式正确的是
| A.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- =Fe3+ + NO↑+ 2H2O |
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: Fe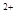 +2H +2H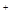 +H2O2=Fe +H2O2=Fe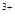 +2H2O +2H2O |
| C.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
| D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
| A.1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| B.常温下,16gO2和O3的混合气体中含有的氧原子数为NA |
| C.标准状况下,22.4 L NO 和22.4 L O2 混合后所得气体中分子总数为1.5 NA |
| D.将11.2 L Cl2 通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
下列各组离子,在碱性条件下能大量共存,在强酸性条件下发生氧化还原反应的是
| A.Mg2+、Na+、SO42-、HCO3— |
| B.NH4+、Na+、SO42—、NO3— |
| C.K+、Na+、SiO32—、ClO— |
| D.Na+、K+、NO3—、SO32— |