已知还原性强弱:I- > Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
下列各组中两溶液间的反应,均可用同一离子方程式表示的是
| A.HCl和Na2CO3、HCl和NaHCO3 |
| B.铜和浓硝酸、铜和稀硝酸 |
| C.KOH和CuCl2、Ba(OH)2与CuCl2 |
| D.铁和稀盐酸、铁和稀硝酸 |
下列用洗净的废铜屑制备硝酸铜的方案中,能节约原料和防止环境污染的是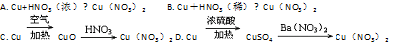
下列有关实验的描述中,正确的是
①钠放入水中后,沉在水下缓缓冒出气体
②Na2CO3和NaHCO3的溶液都可以使无色酚酞试液变红
③氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
④将某气体通入品红溶液中,红色褪去,说明该气体一定是SO2
⑤向某溶液中加入烧碱溶液,加热后生成使湿润红石蕊试纸变蓝的气体,说明原溶液中有NH4+。
⑥过氧化钠与水反应放出大量热
| A.①③⑥ | B.②④⑤ | C.②⑤⑥ | D.③④⑤ |
下列各组离子,在溶液中能大量共存的是
| A.Ca2+、Na+、CO32-、NO3- | B.Na+、HCO3-、Cl-、OH- |
| C.Na+、Al3+、Cl-、SO42- | D.H+、Fe2+、NO3-、SO42- |
实验室制取干燥的下列气体,收集方法和使用的干燥剂可以完全相同的是
| A.H2和CO2 | B.CO2和O2 | C.Cl2和NH3 | D.NH3和O2 |