(共8分)(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
(1)①c电极的名称为________,d电极上的电极反应式为 。
②如图2所示电解100mL 0.5mol·L-1 CuSO4溶液。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_____(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______(填字母序号)。a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
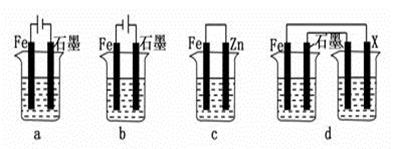
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品: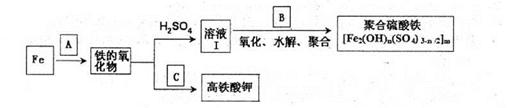
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-):____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+______。
工业合成氨与制备硝酸一般可连续生产,流程如下:
请回答下列问题:
(1)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量,对反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,N2的转化率最高的是(填字母)。
③要使反应后氨的百分含量最大,则在起始体系中原料投料比n(H2)/n(N2)3(填 “>”、“<”、“=”或“无法确定”)。若容器容积恒为1 L,起始状态n(H2)="3" mol,反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=。(结果保留小数点后两位)
(2)已知:N2(g)+O2(g) 2NO(g)ΔH=+180.5 kJ·mol-1
2NO(g)ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
今有17 g氨气,假设其经催化氧化完全反应,生成一氧化氮气体和水蒸气,则该过程中所放出的热量为kJ。
(3)在装置②中,NH3和O2从145℃就开始下列反应,在不同温度和催化剂条件下生成不同产物(如下图所示):
温度较低时生成为主,温度高于900℃时,NO产率下降的可能原因是。
Ⅰ铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子的物质的量是mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为。
Ⅱ某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH 随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是、。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是。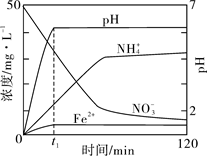
氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:
下列有关该反应的叙述正确的是
| A.正反应活化能小于169.8kJ·mol-1 |
| B.逆反应活化能一定小于169.8kJ·mol-1 |
| C.正反应活化能不小于169.8kJ·mol-1 |
| D.正反应活化能比逆反应活化能小169.8kJ·mol-1 |
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应(填写字母)。

(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是(写化学式)。
(5)已知下列物质的KSP: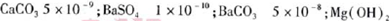
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42—[c(SO42—)>c(Ca2+)]。某精制流程如下: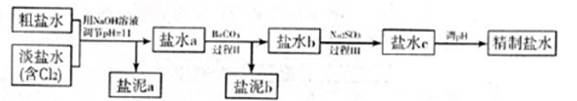
①盐泥a除泥沙外,还含有的物质是。
②过程I中将NH4+转化为N2的离子方程式是。
③过程II中除去的离子有。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液kg(溶液体积变化忽略不计)
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为;为了尽可能多地实现 向
向 的转化,请你提出一条可行性建议。
的转化,请你提出一条可行性建议。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+  O2(g)=CO2(g)△H=-283.0kJ·mol-1
O2(g)=CO2(g)△H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s |
0 |
2 |
3 |
4 |
| c(NO)/mol·L-1 |
1.00×10-3 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 |
 |
 2.70×10-3 2.70×10-3 |
①前2s内的平均反应速率v(CO)=;
②在该温度下,反应的平衡常数K=;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积