由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(其它生成物未在图中列出)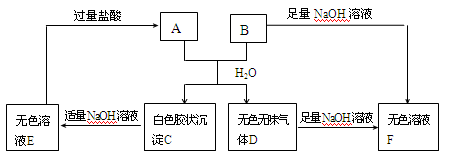
(1)无色溶液F中,一定含有的溶质的化学式为 。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________。
(3)A和B的混合物溶于水发生反应的离子方程式______________________。
(4)将B与E的溶液混合时,可观察到的现象是_________________________,写出其反应的离子方程式__________________________________________。
推断题
I、如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
(1)写出反应类型:④ ,⑤ 。
(2)反应②的条件是_______________;
(3)写出化学方程式:B→C______________________。
II、化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: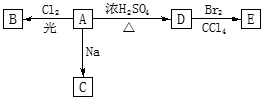
①A分子中的官能团名称是_________ 。
②D→E的现象是 。
③A只有一种一氯取代物B。写出由A转化为B的化学方程式:_______________;
④A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是________。
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。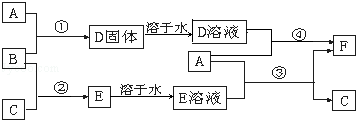
请回答:
(1)写出A与B反应的化学方程式: 。
(2)写出第④步反应的离子方程式为 。
(3)写出向F溶液中通入B时发生反应的离子方程式 。
(4)写出Cu与D溶液反应的离子方程式 。
(5)用离子方程式表示D溶液中滴加KSCN溶液显红色的原因 。
(6)向F溶液中滴入NaOH溶液过程中发生的氧化还原反应化学方程式为 。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
Ⅰ.某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)写出A的结构简式 。
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:  。它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
。它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(3)下列有关“亮菌甲素”的叙述正确的是 (填字母)。
| A.“亮菌甲素”能与H2发生加成反应 |
| B.不能使酸性KMnO4溶液褪色 |
| C.“亮菌甲素” 的分子式是C12H10O5 |
| D.“亮菌甲素”分子中含氧官能团只有2种 |
(4)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式 。
(5)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式 。
E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。
(1)请写出E的电子式 。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②: ,反应类型 。
反应④: ,反应类型 。
反应⑤: ,反应类型 。
(3)比较反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度。