一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3 (g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向逆反应方向进行
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: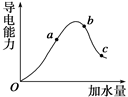
(1)O点为什么不导电。
(2)a、b、c三点醋酸的电离度最大的是___(填“a”、“b”或“c”)。
(3)a、b、c三点的c(H+)由大到小的顺序是____________。
(4)在25℃时,已知c点溶液中pH="5," 则溶液中的c(OH-)=。
(5)若使c点溶液中的c(CH3COO-)增大,不可以采取下列措施中的________(填序号)。
| A.加热 | B.加水 | C.加NaOH固体 | D.加入锌粒 |
(6)随溶液的稀释,下列各项中始终保持增大趋势的是________(填序号)。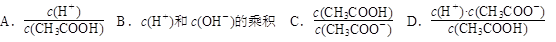
某同学按下图所示的装置进行电解实验。下列说法正确的是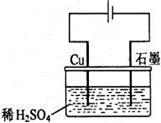
| A.电解过程中,铜电极上有H2产生 |
| B.电解过程中,铜电极不断溶解 |
| C.电解过程中,石墨电极上始终有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
在同体积0.1 mol·L-1的H2SO4、HCl、CH3COOH溶液中,加入足量的Zn,下列说法中错误的是
| A.硫酸中放出氢气量最多 | B.反应速率H2SO4>HCl> CH3COOH |
| C.放出氢气量:HCl> CH3COOH | D.放出氢气量:HCl= CH3COOH |
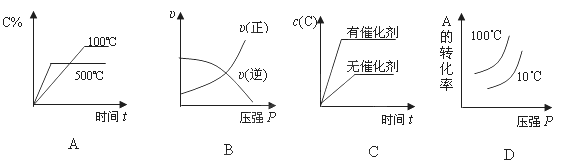
对化学平衡移动的分析,下列说法正确的是
A.已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 |
B.已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 |
| C.改变外界条件使正反应速率大于逆反应速率时,化学平衡一定向正反应方向移动 |
D.已达平衡的反应N2(g)+3H2(g) 2NH3(g),在恒压反应器中充入稀有气体,平衡不移动 2NH3(g),在恒压反应器中充入稀有气体,平衡不移动 |
对于可逆反应:2A(g)+B(g)  2C(g); △H <0,下列各图正确的是
2C(g); △H <0,下列各图正确的是