下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。则下列叙述正确的是
A.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
B.C—H键键长小于H—H键
C.C≡C键能为796.0 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
下列图示与叙述正确的是
| A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 |
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大 3C (g)+D (s)的影响且甲的比乙的压强大 |
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) |
| D.图丁所示装置可证明溴与苯发生取代反应 |
下列关于氧化性、还原性的判断正确的是
| A.B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 |
| B.发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 |
| C.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3 |
| D.一定量氯气通入30 mL 10.00 mol·L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是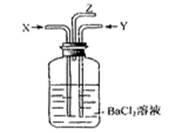
| A.洗气瓶中产生的沉淀是BaCO3 | B.在Z导管出来的气体中无CO2 |
| C.洗气瓶中产生的沉淀是BaSO3 | D.在Z导管口有红棕色气体出现 |
R、L、M三种主族元素,已知R+、L-具有相同电子层结构,M元素原子核电荷数比L元素原子核电荷数少9,L-在一定条件下可被氧化成LM3-,则下列说法正确的是
| A.R、L、M均属于短周期元素 |
| B.离子半径R+>L- |
| C.R、L、M三种元素组成的化合物中既含有离子键又含有共价键 |
| D.L的气态氢化物可形成氢键 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是 c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.①Na2CO3溶液②CH3COONa溶液③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③