金属元素及其化合物在生产生活中应用日趋广泛,根据相关化学知识,回答下列问题:
(1)金属钠在空气中燃烧的产物常用于呼吸面具中的供氧剂,钠原子的结构示意图为 ,请写出其燃烧产物用作供氧剂的原理 。(用化学方程式表示)
(2) Mg的中子数为 ,化合物MgO的化学键类型为 。
Mg的中子数为 ,化合物MgO的化学键类型为 。
(3)重铬酸钾(K2Cr2O7)是一种应用广泛的强氧化剂,利用酸性K2Cr2O7的相关性质可以用来检测酒驾。已知将K2CrO4溶于稀硫酸酸化得到重铬酸钾溶液,请写出酸化K2CrO4制备K2Cr2O7溶液的平衡离子方程式: ,这一过程溶液从 色变成 色。
(4)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属以保护轮船外壳,这种金属防护的方法叫做 。
(5)向5.2g Fe3O4、Fe2O3、Cu的混合物中加入0.5 mol·L-1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为__________g。
称为“塑料王”的是,制取它的方程式为,该反应的反应类型为。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+ |
<0.004 5 mol·L-1 |
| 细菌总数 |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
将W g木炭与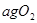 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为 ,高温下容器中木炭与
,高温下容器中木炭与 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为 ,试求:
,试求:
(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以 表示)是______。
表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
(3)在题设条件下,W、a、P、 之间必须满足函数系W=f(a、
之间必须满足函数系W=f(a、 、P),写出该函数表达式:__________________。
、P),写出该函数表达式:__________________。
下表摘自国家环境监测中心公布的某时间我国部分大城市空气监测周报.
| 城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
| 北京 |
92 |
TSP |
Ⅱ |
济南 |
76 |
TSP |
Ⅱ |
| 天津 |
82 |
TSP |
Ⅱ |
武汉 |
83 |
NOx |
Ⅱ |
| 长春 |
103 |
TSP |
Ⅲ |
深圳 |
77 |
NOx |
Ⅱ |
| 上海 |
74 |
NOx |
Ⅱ |
汕头 |
54 |
Ⅱ |
|
| 杭州 |
67 |
TSP |
Ⅱ |
成都 |
87 |
TSP |
Ⅱ |
| 福州 |
42 |
Ⅰ |
重庆 |
98 |
SO2 |
Ⅱ |
|
| 厦门 |
25 |
Ⅰ |
贵阳 |
69 |
TSP |
Ⅱ |
注:TSP:空气中飘尘;NOx:含氮氧化物.
阅读分析上表,回答下列问题:
(1)经济特区中,空气质量最好的城市是________,直辖市中空气质量最差的城市
是________.
(2)最容易出现酸雨的城市是________.为防止城市出现酸雨,降低煤燃烧时向大
气排放的SO2,工业上将生石灰或石灰石和含硫煤混合使用.请写出燃烧时,有
关“固硫”(不使含硫化合物进入大气)反应的化学方程式
___________________________________________________________________.