(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为,丁的酸式电离方程式为。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为 。请回答下列问题:
。请回答下列问题:
(1)B元素是____________,D元素在周期表中的位置是_____________________;
(2)C与E形成的化合物E3C属于________晶体(填“原子”、“离子”或“分子”);
(3)由A、D、E元素组成的化合物中存在的作用力是_________________________;
(4)写出一个E和D形成的化合物与水反应的化学方程式_______________________;
(5)C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X的水溶液显________性(填“酸”、“碱”或“中”),其原因用离子方程式表示:___________
__________________________。
(8分)A、B、C、D四种物质之间有下图所示的转化关系。已知:A是一种非金属单质,为黄色晶体;B、C、D均为化合物;B是形成酸雨的主要成分之一。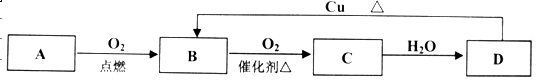
请回答下列问题:
(1)化合物B是 (填化学式,下同),化合物D是 ;
(2)B→C化学反应的类型是 反应(填“化合”、“分解”、“置换”或“复分解”)
(3)向D的稀溶液中滴加BaCl2溶液,能产生白色沉淀。写出该反应的离子方程式:
________________________________________ __________。
(8分)下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
| 族 周期 |
ⅠA |
0 |
|||||||
| 1 |
H |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
F |
Ne |
|||||
| 3 |
③ |
Mg |
④ |
Si |
⑤ |
⑥ |
(1)②表示的元素是 (填元素符号);
(2)①、⑤两种元素的原子半径大小为:① ⑤(填“<”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③ ④(填“<”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式 。
(6分)氮其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是 ;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化学方程式为: ;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是 溶于水(填“极易”或“极难”)。