“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
| A.①④⑥ | B.②③⑤ | C.②③④ | D.①③④⑥ |
在无色强酸性溶液中,下列各组离子一定能大量共存的是
| A.Na+、K+、Cl-、SO42- |
| B.Cu2+、K+、SO42-、NO3- |
| C.K+ 、NH4+、SO42-、CO32- |
| D.Ba2+、Na+、Cl-、SO42- |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是
| A.未洗涤烧杯和玻璃棒 |
| B.转移溶液前溶液未冷却至室温 |
| C.容量瓶未干燥 |
| D.定容时俯视液面 |
下列对有关实验事实的解释正确的是
| A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42 |
| D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
下列离子方程式书写正确的是
| A.硫酸铝与氨水反应:Al3++3OH-=Al(OH)3 ↓ |
| B.碳酸钙溶于醋酸:CaCO3+2H+ =Ca2++H2O+CO2 ↑ |
| C.氯气跟水反应:Cl2 + H2O = 2H++ Cl-+ClO- |
| D.NaHCO3溶液中加入盐酸:H++HCO3-= CO2↑+H2O |
实验室里也可以利用以下反应制取少量氯气:KClO3+6HCl(浓)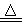 KCl+3H2O+3Cl2↑,关于该反应的说法正确的是
KCl+3H2O+3Cl2↑,关于该反应的说法正确的是
| A.KClO3中的氯元素被氧化 |
| B.每生成1mol Cl2转移电子的物质的量为6mol |
| C.还原剂是HCl |
| D.Cl2既是氧化剂,又是还原剂 |