已知①2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol ②2H2(g)+O2(g)=2H2O(g);
ΔH =-483.6kJ/mol。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g);ΔH为
| A.+262.6kJ/mo1 | B.-131.3kJ/mol |
| C.-352.3kJ/mol | D.+131.3kJ/mol |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法正确的是:
下列说法正确的是:
A.反应达到平衡时,X的转化率为60% |
B.反应可表示为2Z  X+3Y,其平衡常数为1600 X+3Y,其平衡常数为1600 |
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
D.改变温度可以改变此反应的平衡常数 |
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的 是
是
A.刚充入时反应速率υ正减少,υ逆增大
B.平衡不发生移动
C.平衡向逆反应方向移动
D.物质C的质量分数增大
对于可逆反应A(g)+2B (g) 2C (g)(正反应吸热),下列图象中正确的是
2C (g)(正反应吸热),下列图象中正确的是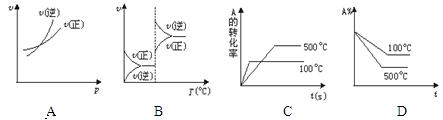
在某温度下,可逆反应mA + nB  pC + qD的平衡常数为K,下列说法正确的是
pC + qD的平衡常数为K,下列说法正确的是
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K越小,达到平衡时,反应物的转化率越大 |
| C.K随反应物浓度的改变而改变 |
| D.K随温度和压强的改变而改变 |
一定条件下,可逆反应C(s) + CO2(g) 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.①② | D.①③④ |