合成氨反应:N2(g)+3H2(g)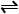 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图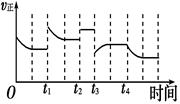
下列说法正确的是
| A.t1时升高了温度 |
| B.t2时使用了催化剂 |
| C.t3时增大了压强 |
| D.t4时降低了温度 |
下列对于某些离子的检验及结论中一定正确的
| A.加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
下列过程中,共价键被破坏的是
| A.HCl气体溶于水 | B.酒精溶于水 |
| C.冰融化成水 | D.碘升华 |
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
下列反应的离子方程式中错误的是
| A.氯化铝溶液中加入过量的氨水Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| B.用醋检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+==Ca2++H2O+CO2↑ |
| C.将铜屑加入Fe3+溶液中: 2Fe3++Cu=2Fe2++Cu2+ |
| D.将铝片放入过量NaOH溶液中2Al+2OH-+2H2O=2AlO2-+3H2↑ |
若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C.14 g氮气中含有7NA个电子 |
| D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4 |