现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水的混合液,分离它们的正确方法依次是
| A.分液、蒸馏 | B.萃取、分液 | C.分液、萃取 | D.蒸馏、分液 |
如图所示,在A处通入氯气,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C 处的红布条逐渐褪色。有以下几种溶液,则D瓶中盛放的溶液可能是
①浓硫酸 ②NaOH溶液 ③H2O ④饱和氯化钠溶液
| A.①③ | B.①② | C.②③ | D.②④ |
NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是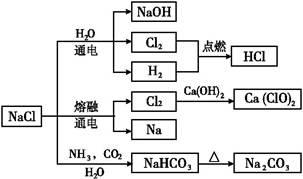
| A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.如图所示转化反应都是氧化还原反应 |
下列反应原理不符合工业冶炼金属实际情况的是
A.2HgO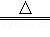 2Hg+O2↑ 2Hg+O2↑ |
B.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
C.2MgO(熔融)  2Mg+O2↑ 2Mg+O2↑ |
D.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
对于4℃时,水中溶解了22.4L HCl气体(标准状况下测得)后形成的溶液200mL,下列说法中正确的是
| A.该溶液物质的量浓度为10mol/L |
| B.所用水的体积为177.6L |
| C.根据题干数据,该溶液物质的量浓度无法求得 |
| D.该溶液中溶质的质量分数因溶液的密度未知而无法求得 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似.下列关于“钴酞菁”分子的说法中正确的是
| A.在水中所形成的分散系属悬浊液 |
| B.分子直径比Na+小 |
| C.在水中形成的分散系能产生丁达尔效应 |
| D.“钴酞菁”分子不能透过滤纸 |