既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是①Al(OH)3 ②Al2O3 ③Al ④NaHCO3 ⑤Mg(OH)2
| A.①③④⑤ | B.①②③④⑤ | C.①②④ | D.①②④⑤ |
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是()
A.Al B .Al(OH)3C.AlCl3 D.Al2O3
.Al(OH)3C.AlCl3 D.Al2O3
大多数碳的化合物都是共价化合物,其原因是( )
| A.碳原子最外电子层有4个电子 | B.碳元素是非金属元素 |
C.碳有多种同素异形体 |
D.碳元素有三种同位素 |
已知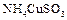 与足量的10 mol/L硫酸混合微热,产生下列现象:
与足量的10 mol/L硫酸混合微热,产生下列现象:
①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色
据此判断下列说法正确的是()
| A.反应中硫酸作氧化剂 |
B.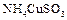 中硫元素被氧化 中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
D.1 mol 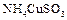 完全反应转移0.5 mol电子 完全反应转移0.5 mol电子 |
欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来
加以分离,加入试剂 ①Cl—②SO42—③OH—④CO2⑤CO32—的正确顺序是()
| A.①②③④ | B.③⑤①② | C.②①③⑤ | D.①⑤③② |
下列离子方程式书写正确的是()
| A.铜溶于浓硝酸: Cu +4HNO3 (浓)=Cu2+ + 2NO2↑+2H2O |
| B.硫酸铁溶液与氢氧化钡溶液混合: Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓ |
| C.次氯酸钙溶液中通入过量的CO2: ClO—+H2O+CO2=HCO3—+HClO |
| D.碳酸氢镁与足量的石灰水反应: |
Mg2++2HCO3—+2OH—+Ca2+=CaCO3↓+MgCO3↓+2H2O