甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、
HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
| A.甲溶液含有Ba2+ | B.乙溶液含有SO42- |
| C.丙溶液含有Cl- | D.丁溶液含有Mg2+ |
下列各反应的离子方程式中,正确的是
| A.铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| B.硫酸铝溶液中加入过量的氨水:Al3++3 OH-===Al(OH)3↓ |
| C.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O |
| D.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O===2Al(OH)4-+3H2↑ |
下列各组离子在指定溶液中,能大量共存的是
| A.含有NaClO的溶液中:K+,NH4+,Fe3+,Br-,SO32- |
| B.所含溶质为Na2S2O3的溶液:K+、SO42-、NO3-、H+ |
| C.加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42- |
| D.使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |
实验室中制取、洗气并收集气体的装置如图所示。仅用此该装置和表中提供的物质完成相关实验,最合理的选项是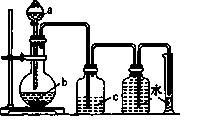
| 选项 |
a中的液体 |
b中的固体 |
c中液体 |
| A |
浓盐酸 |
MnO2 |
饱和食盐水 |
| B |
浓氨水 |
生石灰 |
浓H2SO4 |
| C |
浓硫酸 |
Cu片 |
NaOH溶液 |
| D |
稀HNO3 |
Cu片 |
H2O |
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
| A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如上图变化关系 |
| B.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
下列排列顺序正确的是
①热稳定性:HF> H2O>NH3②离子半径:Na+>Mg2+>F-
③物质的熔点:石英>食盐>冰④结合质子能力:OH->C6H5O-> HCO3-
⑤分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
| A.①③⑤ | B.①③④⑤ | C.②④ | D.全部 |