(22分)现有下列九种物质:
①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
能导电 |
非电解质 |
电解质 |
| 属于该类的物质 |
|
|
|
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑨在水中的电离方程式为 ,
34.2g⑨溶于水配成250mL溶液, SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为: 。
(5)将②加入NaOH的溶液中反应的离子方程式
(6)②与⑧发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是
(填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
【化学——选修5:有机化学基础】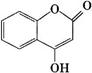 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,写出该反应的离子方程式 ;。
(2)B→C的反应类型是______________________________________。
(3) 写出D→E的化学方程式: _____________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式: _______________________________________。
(5)下列关于G的说法正确的是_____。
| A.能与溴单质反应 | B.能与金属钠反应 |
| C.1 mol G最多能和3 mol氢气反应 | D.分子式是C9H6O3 |
(6)E的同分异构体很多,除E外符合下列条件的共种。
①含苯环且能与氯化铁溶液显色, ②苯环上有两个取代基, ③含酯基。
(7)F分子中有种不同化学环境的氢原子
【化学——选修物质结构与性质】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是,它的外围电子的电子排布图为。P元素属于区元素,
(2)XZ2分子的空间构型是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是 ____________________。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。
求该晶胞密度的计算式为g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是 ,
1 mol三聚氰胺分子中 σ键的数目为 。
(15分)【化学—选修化学与技术】
印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。
假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________
(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式________________________________。
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) 2B(g)+C(g)+D(s)△H= +85.1kJ·mol-1
2B(g)+C(g)+D(s)△H= +85.1kJ·mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
| 时间t/ h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
 |
1.00 |
1.50 |
1.80 |
2.20 |
2.30 |
2.38 |
2.40 |
2.40 |
回答下列问题:
(1)下列能提高A的转化率的是________
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体He,使体系压强增大到原来的5倍
E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K________________,前2小时C的反应速率是___________ mol.L-1.h-1;
(3)平衡时A的转化率_____________, C的体积分数_________(均保留两位有效数字);
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围n(D)_______mol
(5)已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将amol CH3COONa溶于水配成溶液,向其中滴加等体积的bmol·L-1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=___________
Ⅰ.重铬酸钾是工业生产和实验室的重要氧化剂,重铬酸钾的溶解度随温度影响较大。工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的作用是。
(2)步骤③调节pH后过滤得到的滤渣是。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式。
(4)用简要的文字说明操作⑤加入KC1的原因。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
判断达到滴定终点的依据是。
Ⅱ.氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力。氨氧燃料电池示意图,回答下列问题
(1) a电极的电极反应式为_________________________;
(2)反应一段时间后,电解质溶液的pH将_________
(填“增大”“减小”或“不变”);
(3)已知:①N2(g)+3H2(g)=2NH3(g) △H="-92.4" kJ/mol,
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,
试写出氨气完全燃烧生成气态水的热化学方程式:________________________;