ⅠPM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)与A同族但相对原子质量比A小的元素B的原子结构示意图为 .
(2)C与氢氟酸反应的化学方程式是 .
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,生成了含A的化合物F.
①生成D和F的化学方程式分别为 、 .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A.普通玻璃坩埚B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚.
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。则
(1)该合金中铜与镁的物质的量之比是__________
(2)该浓硝酸中HNO3的物质的量浓度是___________mol/L
(3)NO2和N2O4的混合气体中,NO2的体积分数是_____________
(4)得到2.54 g沉淀时,加入NaOH溶液的体积是______mL
下表中列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:
| 元素 |
有关信息 |
| A |
元素主要化合价为-2,原子半径为0.074nm |
| B |
所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C |
原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D |
最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E |
原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
(1)写出A、E两种元素符号 、 。
(2)画出B原子的核外电子排布式: ;写出D元素最高价氧化物对应水化物的电子式: 。
(3)盐X水溶液显 (选填“酸”、“碱”或“中”)性,用离子方程式解释其原因: 。
(4)D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 。
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为 ,Y所含的化学键为 。
(a)极性键 (b)非极性键 (c)离子键
100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。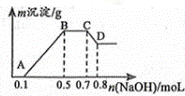
则(1)溶液中一定含有的阳离子有 ,一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为 mol•L﹣1和 mol•L﹣1
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1 mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题:
(1) Q的离子结构示意图为________________。
(2)Y元素的单质能发生如图所示的转化,则Y元素为____________(填元素符号)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是 (用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为___________。
②Q、W两种元素金属性的强弱为Q________W(填“<”或“>”),下列表述中能证明这一事实的是________(填序号)。
a.Q单质的熔点比W单质的低
b.W的原子序数大
c.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强