下列指定反应的离子方程式正确的是
| A.Cu溶于稀硝酸: Cu+2H++NO3- ==Cu2++NO2↑+H2O |
| B.在复盐NH4Fe(SO4)2溶液中加入一定量的Ba(OH)2溶液:2Fe3++3SO42-+3Ba2++6OH-==3BaSO4↓+2Fe(OH)3↓ |
| C.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+ ="=" CO2↑+3H2O |
| D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O ==Al(OH)3↓+HCO3- |
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是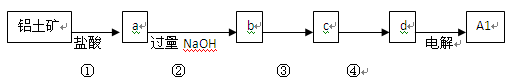
| A.①、②中除加试剂外。还需要进行过滤操作 |
| B.a 、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d 一定是氧化铝 |
干燥剂的干燥性能值可用干燥效率(1 m3空气中实际残留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
根据以上数据,下列叙述错误的是()
| A.上述干燥剂中阳离子对干燥效率的影响比阴离子小 |
| B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关 |
| C.MgCl2可能是比CaCl2更好的干燥剂 |
| D.MgO的干燥性能比CaO好 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到右下图,则曲线a所对应的实验组别是()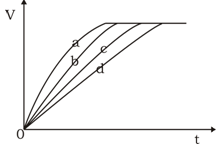
| 组别 |
c(HCl)(mol·L-1) |
温度(℃) |
状态 |
| A |
2.0 |
25 |
块状 |
| B |
2.5 |
30 |
块状 |
| C |
2.5 |
50 |
粉末状 |
| D |
2.5 |
50 |
块状 |
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应后Cr和一部分Fe呈+3价,且反应后铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是()
| A.消耗硫酸亚铁的物质的量为n(2-x) | B.处理废水中的Cr2O72-的物质的量为nx/2 |
| C.反应中发生转移的电子数为3nxmol | D.在FeO·FeyCrxO3中,3x="y" |
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是()
| A.它是一种共价化合物 | B.它既含离子键又含共价键 |
| C.它不可能与NaOH溶液反应 | D.它受热时,不能分解产生有色气体 |