反应2SO2(g)+O2(g)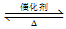 2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
| A.②④①③ | B.④②①③ | C.④③②① | D.②④③① |
下列物质属于纯净物的是
| A.甲烷与氯气在光照下取代的有机产物 | B.铝热剂 |
| C.明矾 | D.汽油 |
下列烷烃分子中去掉一个氢原子后所得的烃基不止一种的是
| A.甲烷 | B.乙烷 | C.丙烷 | D.丁烷 |
1molCH4与Cl2发生光照下反应,生成相同物质的量的4种取代物,则消耗的Cl2的物质的量为
| A.0.5 mol | B.2 mol | C.2.5 mol | D.4 mol |
将20mL 0.1 mol/L 的氢氧化钠溶液和10mL 0.1 mol/L 的醋酸溶液混合后,蒸干并强热,最终得到的固体是( )
| A.NaOH | B.CH3COONa |
| C.NaOH 和 CH3COONa | D.Na2CO3 |