密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是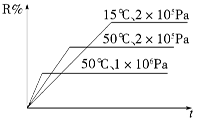
| A.正反应吸热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应放热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
下列实验操作中错误的是 ()
| A.蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
下列化学实验操作或事故处理方法正确的是()
| A.圆底烧瓶可以直接用酒精灯加热 |
| B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C.酒精灯着火时可用水扑灭 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
下列物质中属于非电解质的是()。
| A.NaOH | B.O2 | C.Na2CO3 | D.乙醇 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数为 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为 NA |
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
| A.形成较多的白色沉淀 |
| B.形成的沉淀纯度更高 |
| C.排除SO42- 以外的其它阴离子及Ag+的干扰 |
| D.排除Ba2+ 以外的其它阳离子的干扰 |