化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3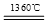 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3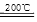 CuO+ CO2↑
CuO+ CO2↑
下列说法不正确的是
| A.氧化性(酸性溶液):PbO2>Fe3+>S |
| B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2 |
| C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D.热稳定性:CaCO3>FeCO3>Ag2CO3 |
近年来,科学家合成了一系列具有独特化学特性的氢铝化合 物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是()
| A.Al2H6在固态时所形成的晶体是分子晶体 |
| B.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| C.Al2H6中含有离子键和极性共价键 |
| D.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
中学化学中很多规律都有其使用范围,下列根据有关“规律”推出的结论合理的是()
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
化学反应可视为旧键断裂和新键生成的过程。键能是形成(拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360,O-O:498,则化学反应P4(白磷)+3O2=P4O6的反应热△H为 ()
| A.-1638 kJ·mol-1 | B.+1638 kJ·mol-1 |
| C.-126 kJ·mol-1 | D.+126kJ·mol-1 |
向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4•H2O。下列说法不正确的是 ()
| A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子 |
| B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小 |
| C.碱式硫酸铜与氨水反应的离子方程式 Cu2(OH)2SO4 + 8NH3•H2O = 2[Cu(NH3)4]2+ + SO42- + 2OH- + 8H2O |
| D.深蓝色晶体中只含有离子键、配位键和氢键 |
下列关于晶体的说法一定正确的是()
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.熔融时化学键没有破坏的晶体一定是金属晶体 |