下列分子的空间构型可用sp3杂化轨道来解释的是
①PCl3 ②CH2===CH2 ③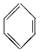 ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
| A.①②③ | B.①⑤⑥ | C.②③④ | D.③⑤⑥ |
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是()
| A.S | B.C | C.Si | D.Cl |
下列微粒中半径最小的是()
| A.Na | B.Na+ | C.Mg2+ | D.K |
不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是()
| A.温度 | B.浓度 | C.催化剂 | D.反应物的性质 |
在反应A(g) + 2B(g) = 2C(g)中,1s内A的物质的量浓度减少0.1mol/L,则用C表示的化学反应速率为()
| A.0.1mol/(L.S) | B.0.2mol/(L.S) | C.0.01mol/(L.S) | D.0.02mol/(L.S) |