(7分,除方程式外每空1分)A、B、C是中学化学中常见的三种短周期元素。
已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和强碱溶液反应的离子方程式___________________。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:_ _ 。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:_ _ 。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(4)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为_____________,其熔沸点比金刚石_____(填“高”、“低”或“无法比较”)。
Ⅰ.下列物质中:①氯化钠②干冰③盐酸④铜⑤硫酸钡⑥蔗糖
⑦I2⑧熔融的硝酸钾⑨食盐水
(1)能导电的是(填编号,下同) ;
(2)属于电解质的是 ;
(3)属于非电解质的是 。
Ⅱ.100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子 个,含Al3+离子 mol。0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z的原子结构示意图是.
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1。化学式为。YX3与水2种粒子结合质子 的能力由强到弱的顺序是(用离子方程式加以说明)。
的能力由强到弱的顺序是(用离子方程式加以说明)。
(3)Z2W2分子的电子式为。
(4)YW3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质,写出反应的方程式;该反应说明Y和W两种元素非金属性较强的是(填元素的符号)。空间构型是
在一个2L的密闭容器中,投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示: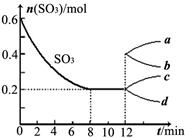
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果。
(2)用O2表示0到8min内该反应的平均速率v=。
(3)能说明该反应已达到平衡状态的是。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正D.容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为。
A.a B.b C.c D.d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向反应方向移动(填“正”或“逆”)。SO3的体积分数(填“增大”或“减小”)。
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如下图所示(忽略温度变化)。请回答下列有关问题:
(1)a点溶液中c(H+)为。
(2)b点溶液中离子浓度的大小顺序可能有种情况。
(3)a、b、c三点中水的电离程度最大的是。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
⑴在④操作中用到的量取仪器是。以上步骤有错误的是(填编号),该错误操作会导致测定结果有误差。下列操作会造成同样的测定结果的是。
①锥形瓶用待测溶液润洗②滴定前读数正确,滴定后俯视读数
③碱式滴定管滴定前无气泡,滴定终点时有气泡④滴定前读数正确,滴定后仰视读数
⑤配制NaOH溶液时,称量的NaOH中含NaCl⑥振荡锥形瓶时部分液体溅出
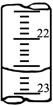
⑵如下图是某次滴定时的滴定管中的液面,其读数为mL。