填写下列空格:
(1)草木灰(含K2CO3)显碱性的原因是(用离子方程式表示) ,所以 (填“能”或“不能”)与铵态氮肥混合施用。
(2)室温下pH=9的NaOH溶液中,由水电离产生的c(OH-)为 mol/L;把0.1mol/L HCl与0.3mol/L的NaOH溶液等体积混合,所得溶液的pH= 。
(3)3mol/L 100mL H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生的H2的总量不变,可采取的措施______(填下列选项的序号)
| A.加醋酸钠固体 | B.加NH4Cl溶液 | C.加BaCl2溶液 | D.加氨水 |
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
混合气体中有 A 的形成过程。
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色黄色
试回答下列问题:
(1)欲使溶液由黄色变为蓝色,可采取的两种方法为:①;②。
(2)欲使溶液由蓝色变为绿色,可采取的两种方法为:①;②。
(1)写出一个以离子浓度表示的电荷守恒等式:。
(2)写出一个含有c(OH-)和c(H+)的等式:。
(3)根据Na3PO4中Na、P原子个数关系,写出一个含有c(Na+)和c(PO )的等式:。
)的等式:。
(1)根据电荷守恒,写出一个用离子浓度表示的等式:;
(2)根据水的电离,写出一个含有c(H+)和c(OH-)的等式:;
(3)根据(NH4)2CO3中,C、N原子个数关系,写出一个含有c(NH+4)和c(CO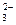 )的等式:。
)的等式:。
某常见有机物式量为92,与足量丙酸完全酯化,所得产物的式量是260。则该常见有机物分子中羟基个数为____________(填数字),其水溶性为____________(填“溶解”或“不溶解”)。