A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A B C D
(2)写出实验步骤②中A盐产生白色沉淀的离子方程式:
(共18分)现有下列物质:
a.石墨 b.CO2 c.CaO d.H2SO4 e.稀盐酸 f.Ba(OH)2
g.固体纯碱 h.稀豆浆 i.Fe(OH)3j.NaCl溶液 k.H2O
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 所属类别 |
混合物 |
碱 |
溶液 |
胶体 |
电解质 |
| 物质编号 |
① |
② |
③ |
④ |
⑤ |
(2)在上述d、e、g、j四种物质中,能导电的有 (填编号,可多选)
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式: ;如果病人同时患胃溃疡,不能服用小苏打,原因是: ;此时最好用含氢氧化铝的胃药(如斯达舒)离子方程式: 。
(共16分)
(1)在标准状况下,由CO2和SO2组成的混合气体8.96L,质量是23.6g。此混合物中CO2和SO2的物质的量比是 ① ,SO2的体积分数是 ② , S和O的原子个数比是 ③ 。
(2)现有200 ml Fe2(SO4)3的溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 ④ 。
(3)在反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,得电子的物质是⑤ ,参加反应HNO3的和被还原的HNO3分子个数比为⑥ ,当生成的NO在标准状况下的体积为11.2L时,该反应转移的电子的物质的量为⑦ mol。
化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染,营造安全的生态环境已成为全人类的共识。
①天然水中杂质较多,常需加入明矾、氯化铁等作混凝剂进行处理,混凝剂溶于水后生成的胶体可以吸附水中的悬浮颗粒。请以明矾为例,用离子方程式表示该净水原理 。
②垃圾处理要遵循无害化、减量化和 的原则。
③在汽车尾气系统中装置催化转化器,由于含铅化合物会使 ,所以装有催化转化器的汽车必须使用无铅汽油。
(2)保证食品、药品安全,保持营养均衡,是人体健康的基础。
①人体需要的营养素主要有糖类、油脂、蛋白质、 、维生素和水。在氢、氮、铁、氯、钙这几种元素中,属于人体生命活动必需的微量元素是____________。
②抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、淀粉。
写出该抗酸药发挥功效时的离子方程式:________________________________。
③如果不注意控制酸性食物的摄入,就会导致血液偏酸,甚至形成“ 症”,引起人体缺钙、血液黏度增大等。
④阿司匹林是一种人工合成药物,结构简式如右图,常温下与NaOH反应可以得到可溶性钠盐,有比阿司匹林更好的疗效。
请写出此反应的方程式: 。
(3)丰富多彩的材料为人类的生存和发展创造了完美的物质条件。石英玻璃的主要成分为 。有机玻璃受热时会软化,易于加工成型。有机玻璃是一种 (选填“橡胶”或“纤维”或“塑料”)。有些塑料只是在制造过程中受热时能变软,可以塑制成一定的形状,但加工成型后就不会受热熔化,具有 。橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为________结构,从而增大橡胶的强度。
为了人类的可持续发展,我们应综合利用资源.保护环境,跟自然和谐相处:
(1)科学家研制出有“自我修复能力”的塑料。塑料属于 (选填 “无机”、“合成”或“复合”)材料,为我们到来了方便,但废弃塑料处理不当会对环境造成不利的影响,人们把废弃塑料给环境带来的危害称为“ ”,发电厂是利用垃圾焚烧产生的 转变为电能。
(2)发射“嫦娥三号”的长三甲火箭燃料是偏二甲肼(X),反应的化学方程式为:X+2N2O4=3N2+2CO2+4H2O,则X的化学式为 。
A.H2 B.CH4 C.C2H8N D.C2H8N2
(3)2014年3月22日是第二十二个“世界水日”,它的主题是“水与能源”。关于水的知识有下列话题,请按要求填空:
①自来水生产过程中,可用 方法除去水中不溶性杂质。
②在生产生活中水是最常用的溶剂,实验室用蔗糖配制一定溶质质量分数的溶液时,可能涉及以下操作: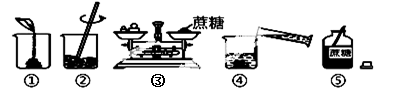
Ⅰ、上图操作中有错误的是 (填序号)。
Ⅱ、改正错误后,表示正确的操作顺序是 (填序号)。
A.⑤②①③④ B.⑤①②③④ C.⑤③②④① D.⑤③①④②
Ⅲ、保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法不利于保护水资源的是 (填序号)。
A.大量使用化肥农药 B.工业废水处理达标后再排放
C.使用含磷洗衣粉D.生活污水直接排放
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| 族 周期 |
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 |
11 Na 钠 22.99 |
12Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题: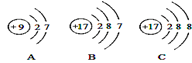
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;