下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是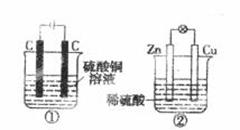
| A.产生气体体积:①=② |
| B.电极反应式:①中阳极为4OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| C.溶液的pH变化:①减小,②增大 |
| D.①中阴极质量增加,②中正极质量减小 |
下列事实不能用勒夏特列原理解释的是()
| A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用催化剂可加快SO2转化为SO3的速率 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
已知:(1)Zn(s)+ O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
(2)2Ag(s)+  O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,
O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,
则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于( )
| A.-379.3 kJ·mol-1 | B.-317.3 kJ·mol-1 |
| C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
在温度相同,压强分别为p1和p2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是()
nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是()
| A.p1>p2 ,n<3 | B.p1<p2 ,n>3 |
| C.p1>p2 ,n>3 | D.p1<p2 ,n<3 |
对于反应:C(S) + H2O(g) CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是()
CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是()
| A.升高反应温度 | B.降低反应温度 |
| C.增大压强 | D.再加入一些C(S) |
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g)  2C(g)+D(g) 已达平衡状态的是 ()
2C(g)+D(g) 已达平衡状态的是 ()
| A.混合气体的压强 | B.混合气体的密度 |
| C.A的物质的量浓度 | D.气体的总物质的量 |