下列电离方程式正确的是
| A.Na2CO3=Na2+ + CO32- | B.Na2SO4=2Na++SO42- |
| C.NaHCO3=Na++H++CO32- | D.NaOH = Na++H++O2- |
已知:P4(s.白磷)+5O2(g)= P4O10(s)△H =-2983.2 kJ·mol-1
4P(s.红磷)+5O2(g)= P4O10(s)△H =-2954 kJ·mol-1
那么,1mol红磷转变成相应物质的量白磷时,应是
| A.吸收29.2 kJ热量 | B.放出29.2 kJ热量 |
| C.放出7.3 kJ热量 | D.吸收7.3 kJ热量 |
已知热化学方程式:SO2(g)+ 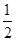 O2(g)
O2(g)  SO3(g)△H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g)△H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
| A.196.64 kJ | B.196.64 kJ·mol-1 | C.<196.64 kJ | D.>196.64 kJ |
下列各图所表示的反应是吸热反应的是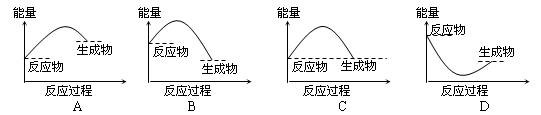
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,
放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.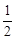 N2H4(g)+ N2H4(g)+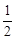 O2(g)==== O2(g)====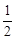 N2(g)+H2O(g);ΔH=+267 kJ·mol-1 N2(g)+H2O(g);ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH =-133.5 kJ·mol-1 |
把分别盛有熔融的氯化钾.氯化镁.氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾.镁.铝的物质的量之比为
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |