选择下列实验方法分离物质,将分离方法的序号填在横线上:
| A.过滤 |
| B.结晶 |
| C.分液 |
| D.蒸馏 |
E.萃取分液
(1) 分离水和植物油的混合物;
(2) 分离饱和氯化钾溶液和沙子的混合物;
(3) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4) 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5) 将碘水中的碘单质与水分离。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。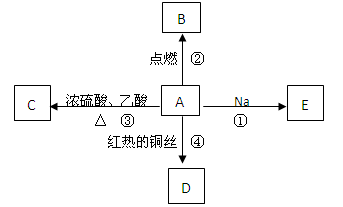
(1)写出A的化学式。
(2)下列反应的化学方程式
反应①;
反应③;
反应④。
(3)比较反应①与钠和水反应的现象有什么相同和不同。
相同点: ;
不同点:
(8分)在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二氧化碳的体积与反应时间的关系如图所示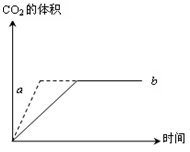
两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,,另一实验用是石灰石粉末,则从图中可以看出:
①使用石灰石块的是 (填a或b,下同),反应速率较快的曲线是,由b图变为a的原因是  ②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。
②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等?(填“相等”或“不相等”)。
将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)写出有关反应的化学方程式。
(2)实验中观察到的现象有、和反应混合物成糊状
(3)通过现象,说明该反应为(填“吸热”或“放热”)反应,这是由于反应物的总能量(填“小于”或“大于”)生成物的总能量
对于反应2S02+02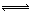 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充人Ne |
(6分)A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图
为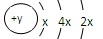 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为,其气态氢化物的化学式为
(2)D在周期表的周期,族。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用元素符号填写)
(4)B的最高价氧化物的水化物的化学式为