2N2O5(g)=4NO2(g)+O2(g) △H=+56.8kJ/mol自发进行的原因是
| A.是吸热反应; |
| B.是放热反应; |
| C.是熵减少的反应; |
| D.熵增大效应大于能量效应。 |
下图是可逆反应A+2B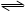 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可以推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可以推断
A.A、B、C、D均为气体
B.若A、B是气体,则C是液体或固体
C.逆反应是放热反应
D.正反应是放热反应
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g) N2O4(g),△H<0,若把烧瓶置于100℃的沸水中,下列物理量没有发生改变的是:①颜色;②平均相对分子质量;③质量;④压强;⑤密度
N2O4(g),△H<0,若把烧瓶置于100℃的沸水中,下列物理量没有发生改变的是:①颜色;②平均相对分子质量;③质量;④压强;⑤密度
| A.③⑤ | B.③④ | C.②④ | D.①③ |
在一个固定容积的密闭容器中发生如下反应:2A(g)+B(g)  3C(g)+D(g),当加入4 mol A和2 molB达化学平衡时,C的物质的量浓度为m mol·L-1,若维持温度不变, 按下列四种配比为起始物质, 达到化学平衡后,C仍为m mol·L-1的是
3C(g)+D(g),当加入4 mol A和2 molB达化学平衡时,C的物质的量浓度为m mol·L-1,若维持温度不变, 按下列四种配比为起始物质, 达到化学平衡后,C仍为m mol·L-1的是
| A.2molA+1molB | B.6molC+2molD |
| C.3molC+1molD | D.4molA+2molB+3molC |
某可逆反应a A(g)+bB(g)  cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
据图分析,以下正确的是
| A.c>a+b,正反应为吸热反应 |
| B.c>a+b,正反应为放热反应 |
| C.c<a+b,逆反应为吸热反应 |
| D.c<a+b,逆反应为放热反应 |
体积相同的甲乙两容器中,分别充入1molA和1molB,在相同温度下发生反应:
2A(g)+B(g)  2C(g) 并达到平衡,甲容器保持体积不变, C的体积分数为m%;乙容器保持压强不变,C的体积分数为n%,则m和n的正确关系为
2C(g) 并达到平衡,甲容器保持体积不变, C的体积分数为m%;乙容器保持压强不变,C的体积分数为n%,则m和n的正确关系为
| A.m<n | B.m="n" | C.m>n | D.无法比较 |