(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题: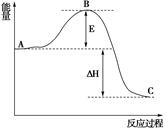
①图中E、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
.(4分)已知某有机物只含C、H、O三种元素。取6.2 g该有机物,在氧气中完全燃烧,产生CO2和H2O分别为8.8 g和5.4 g,通过计算,可获得该有机物的实验式为__________。其分子式为____________。(如能确定分子式填此空,如不能确定分子式则不填此空)
(3分) ABS工程塑料是一种高分子化合物,其结构为, ,写出各单体的结构简式_______
,写出各单体的结构简式_______
(8分)1)已知丁基有四种结构,则丁醇有种同分异构体。
(2)某一元醇中氧的质量分数为18.2%,则该醇的分子式为,若该醇能在铜做催化剂的条件下被氧气氧化生成醛,则符合该条件的该醇有种。若该醇不能发生消去反应,则该醇的结构简式为
写出下列反应的化学方程式。
(1)检验乙醇中是否混有乙醛:
(2)由丙烯制聚丙烯:
(3) 制取TNT:
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是.
(5)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为_______ 。