已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Ce3+、Fe2+、Sn2+ | B.Sn2+、Ce3+、Fe2+ |
| C.Sn2+、Fe2+、Ce3+ | D.Fe2+、Sn2+、Ce3+ |
已知还原性Cl-< Br-< Fe2+<I-,氧化性Cl2>Br2>Fe3+> I2,则下列说法正确的是
| A.在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 |
| B.向FeI2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++ Cl2=2Fe3++ 2C1- |
| C.向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2+ +2Br-+2Cl2=2Fe3++ Br2+4Cl- |
| D.向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++ I2=2Fe3++ 2I- |
关于有机物的说法不正确的是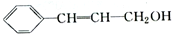
| A.lmol该有机物可以和4molH2反应 |
| B.该有机物分子中所有碳原子不可能共面 |
| C.该有机物可使溴的四氯化碳溶液褪色 |
| D.该有机物含有两种官能团 |
金属在人类社会的发展进程中起着重要的作用。下列有关金属及其化合物的说法正确的是
| A.Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 |
| B.Fe在高温下能与水蒸气反应,Fe被氧化生成Fe2O3,H2O被还原生成H2 |
| C.鉴别Na2CO3和NaHCO3溶液可向两种溶液中加入Ba(OH)2溶液,产生沉淀的就是Na2CO3 |
| D.Al与NaOH溶液的反应中,NaOH既不是氧化剂又不是还原剂 |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.水溶液中:Na+、K+、NO3— |
| B.空气中:CO2、SO2、NO |
| C.氢氧化铁胶体中:H+、K+、I— |
| D.高锰酸钾溶液中:H+、SO42—、CH3CH2OH |
下列说法正确的是
| A.SO2、NO、SiO2都是酸性氧化物 |
| B.PM2.5是指大气中直径接近于2.5×l0 -6m的颗粒物,它在空气中形成气溶胶 |
| C.向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化 |
| D.KCl和SO3溶于水后均能导电,是因为KC1和SO3都为电解质 |