某溶液只含有Na+、Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
| A.3:4 | B.1:4 | C.1:2 | D.3:2 |
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是 ()
A.SO2+H2O H2SO3 H2SO3 |
B.Cl2+H2O=HCl+HClO |
C.3Fe+4H2O(g) Fe2O4+4H2 Fe2O4+4H2 |
D.2Na+2H2O=2NaOH+H2↑ |
BaO2放入密闭真空容器中,反应
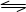

 达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是()
达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是()
| A.氧气浓度不变 |
| B.BaO质量增加 |
| C.BaO2质量不变 |
D.平衡常数 ,且保持不变 ,且保持不变 |
3 H2(g) + N2(g)  2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )
2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )
| A.图中C表示生成物NH3(g)的总能量 |
B.断裂3mol 和1mol 和1mol  所吸收的总能量大于形成6mol 所吸收的总能量大于形成6mol 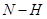 所释放的总能量 所释放的总能量 |
C.逆反应的活化能 |
D.3 H2(g) + N2(g)  2NH3(g) △H< 0 2NH3(g) △H< 0 |
将2mol PCl3和1mol Cl2充人一容积不变的密闭容器中,在一定条件下反应:
PCl3 (g) + Cl2(g) 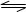 PCl 5 (g)达平衡时,PC15为0.4mol。此时若移走1 molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是 ( )
PCl 5 (g)达平衡时,PC15为0.4mol。此时若移走1 molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是 ( )
| A.0.4 mol | B.小于0.2 mol |
| C.0.2 mol | D.大于0.2 m01而小于0.4 mol |
在密闭容器中发生如下反应: aX(g) + bY(g)  cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
| A.平衡向逆反应方向移动 | B.a + b < c + d |
| C.Z的体积分数增加 | D.X的转化率下降 |