(10分)二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
步骤①:称取a g I2,(加少量KI助溶),配成1L 5×10-3mol·L-1溶液;
步骤②:取步骤①中溶液10mL,稀释至100mL;
步骤③:量取步骤②中溶液5.00mL于试管2中,加入2~3滴淀粉溶液;
步骤④:如图抽气N次至溶液蓝色刚好褪去。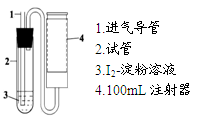
(1)步骤①中配制1L溶液时,除用到天平、药匙、烧杯、量筒、玻璃棒、胶头滴管外,还用到的玻璃仪器有 ;需称量单质碘的质量a为 (保留小数点后两位)。
(2)SO2与碘水反应的离子方程式为 。
(3)实验时,注射器每次缓缓抽气100mL。
①若抽气太快,将导致结果 (选填:“偏大”、“偏小”、“不变”)。
②若某次实验时抽气共80次,试计算该地空气中SO2的含量(mg/L) (写出计算过程)。
(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
A.B.C是三种互不同族也不同周期的短周期元素,原子序数总和为26,它们可以结成一种三原子化合物,这种化合物的化学式是________。
下表是元素周期表的一部分, 针对表中的①~⑦种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
(1)在这些元素中,(用元素符号填写,下同)金属性最强的元素是;非金属性最强的是;最不活泼的元素是。
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是_________;碱性最强的化合物的电子式是________________;能形成两性氢氧化物的元素是_________________________。
(3)②的氢化物分子式为,属于化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为
在一个2L的密闭容器中,发生反应:2SO3 (g) 2SO2+ O2 △H>0,其中SO3的变化如下图示:
2SO2+ O2 △H>0,其中SO3的变化如下图示:
(1)写出该反应的平衡常数表达式: ________________,
(2)用O2表示从0~8min内该反应的平均速率v=。
(3)升高温度,该反应的反应速率将;K值将_______;容器中气体的平均相对分子质量将____。(填:“增大”,“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是。
a.v(SO3)=2v(O2) b.容器内压强保持不变 c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
| A.a | B.b | C.c | D.d |
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为。
(2)在乙池反应过程中,可以观察到电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应式。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为。