下列实验操作完全正确的是
| 编号 |
实验 |
操作 |
| A. |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B. |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C. |
证明某溶液中含Fe2+ |
取少量该溶液先加入氯水,再滴加KSCN溶液 |
| D. |
取出分液漏斗中的上层液体 |
下层液体从分液漏斗下端管口放出,及时关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
用NA表示阿伏加德罗常数。下列叙述正确的是
| A.1.0L0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA |
| C.常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1NA |
| D.高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。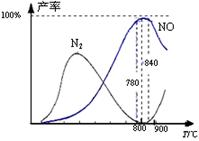
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
| A.工业上氨催化氧化生成 NO时,温度应控制在 780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.加压可提高NH3生成NO的转化率 |
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5 kJ·mol-1 2NO(g) △H=-181.5 kJ·mol-1 |
甘草甜素在治疗丙肝、艾滋病、非典等疾病方面有一定疗效。甘草甜素在一定条件下可转化为甘草次酸。下列有关说法正确的是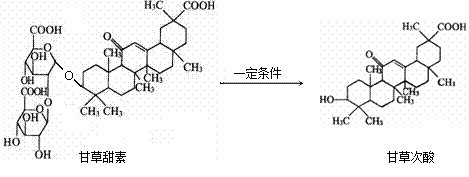
| A.甘草甜素转化为甘草次酸属于酯的水解 |
| B.在Ni催化作用下,1mol甘草次酸最多能与3molBr2发生加成反应 |
| C.甘草甜素能使FeCl3溶液变成紫色 |
| D.甘草甜素、甘草次酸均可与Na2CO3发生反应 |
实验测得常温下0.1 mol·L-1某一元酸(HA)溶液的pH大于1,0.1 mol·L-1某一元碱(BOH)溶液里, 。将两种溶液等体积混合后,所得溶液中各离子的物质的量浓度的关系正确的是()
。将两种溶液等体积混合后,所得溶液中各离子的物质的量浓度的关系正确的是()
A.c(A-)>c(B+)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)+c(H+)=c(A-)+c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
有aA、bB、cC、dD四种短周期元素,d-c=c-b=b-a=5,A、B、C最外层电子数总和等于D最外层电子数,下列说法正确的是()
A.A、B、C、D四种元素可能都是非金属
B.四种元素中的任意两种形成的化合物分子中,只有两种是非极性分子
C.A、B两元素形成的化合物分子,分子间可能形成氢键
D.C、D两元素形成的化合物是离子晶体