用1.0mol·L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示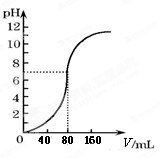
则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
| A.0.5mol·L-1 160mL |
| B.1.0mol·L-1 160mL |
| C.0.5mol·L-1 80mL |
| D.1.0mol·L-1 80mL |
下列各组离子中,在给定条件下能大量共存的是 ( )
| A.c(NO3-)= 1mol.L-1的溶液中:NH4+、Ba2+、Fe2+ 、Br- |
| B.水电离出c(OH-)= 10-10mol.L-1的溶液: HCO3-、K+、Na+、Cl- |
| C.在pH=2的溶液中:NH4+、K+、ClO-、Cl- |
| D.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: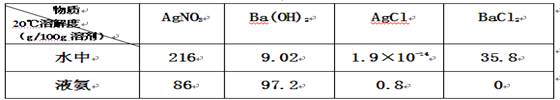
由此溶解度可知在水溶液中上述化合物发生复分解反应为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,那么上述几种化合物在液氨溶液中发生复分解反应的化学方程式()
| A.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 | B.2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C.2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 | D.2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |
高温下,某反应达平衡,平衡常数K=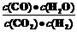 。恒容时,温度升高,H2浓度减小,下列说法正确的是 ()
。恒容时,温度升高,H2浓度减小,下列说法正确的是 ()
| A.该反应的焓变为正值 | B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
下列实验操作或原理不正确的是 ( )
| A.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
| B.抽滤时,滤纸要小于布氏漏斗 |
| C.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
下列说法中,正确的是( )
| A.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| B.凡是能自发进行的化学反应,一定是△H<0、△S>0 |
| C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经润洗后方可使用 |
| D.Ksp与难溶电解质的性质、温度、溶液中的离子浓度等因素有关 |