氯气与冷的氢氧化钠反应生成NaCl与NaClO,与热的氢氧化钠反应生成NaCl与NaClO3.一定温度下,氯气与氢氧化钠反应生成的NaClO与NaClO3的物质的量之比为2:3,求该反应氧化产物与还原产物的物质的量之比为
| A.5/16 | B.5/17 | C.5/13 | D.13/5 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到右上图,则曲线a、b、c、d所对应的实验组别可能是()
| 组别 |
c(HCl)(mol·L-1) |
温度(℃) |
状态 |
| 1 |
2.0 |
25 |
块状 |
| 2 |
2.5 |
30 |
块状 |
| 3 |
2.5 |
50 |
块状 |
| 4 |
2.5 |
30 |
粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)
2C(g)
若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法正确的是
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
| A.①③ | B.①④ | C.②③ | D.③④ |
在2L的密闭容器中进行如下反应:mX(g) pZ(g)+qQ(g)
pZ(g)+qQ(g)
在2秒钟内用X表示的平均反应速率为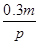 mol/(L·s),则2秒钟内Q物质增加了()
mol/(L·s),则2秒钟内Q物质增加了()
A.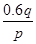 mol mol |
B.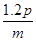 mol mol |
C.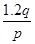 mol mol |
D.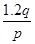 mol mol |
其他条件不变时,能使反应速率加快的是()
| A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强 |
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar 2NH3(g),容器体积固定不变时,充入Ar |
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2 2NH3(g),容器体积固定不变时,充入N2 |
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar 2NH3(g),容器气体压强不变时,充入Ar |
一定温度下,在固定体积的密闭容器中发生下列反应:2HIH2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为()
| A.5s | B.10s |
| C.大于10s | D.小于10s |